Innovative Technologien und komplexe methodische Lösungen bilden den zentralen Kern der wissenschaftlichen Zusammenarbeit am Biotechnologisch-Biomedizinischen Zentrum. Diese Kompetenzen werden am Zentrum in Technologieplattformen gebündelt:
Etablierte Methoden- und Gerätepools bieten mit ihren Infrastrukturen und dem Know-how der Wissenschaftlerinnen und Wissenschaftler eine gute Basis für Kooperationen.
Unsere Methoden- und Gerätepools bieten hochwertige technologische Anwendungen mit Spezialgeräten, die zum Teil Unikate aus Eigenentwicklung sind.
Konkret vor Ort bieten die in der BIO CITY ansäßigen BBZ-Professuren anderen Forschergruppen und Biotech-Unternehmen Infrastruktur und Know-how von neun Technologielinien für spezifische biotechnologische Methoden und Anwendungen wie Mikroskopie und Imaging, Massenspektrometrie und Reinraumtechnologie an.
Folgende Technologieplattformen stehen in der BIO CITY zur Verfügung
Das Gerätezentrum (Core Facility) für Mikrosystem-Technologien der Professur für Biochemische Zelltechnologie bietet universitätsinternen und externen Nutzern:innen Zugang zu einem breiten Spektrum von Technologien im Bereich der Mikrosystemtechnik an.
Zur Core Facility zählen Technologien zur Herstellung von Mikroelektrodenarrays, Abgussformen für Polymerchips (PDMS-Master) und der 3D-Druck von mikrofluidischen Plattformen. Dafür stehen voll ausgestattete Reinräume (Klasse ISO5/7) mit Geräten zur mikrosystemtechnischen Fertigung der Elektrodenarrays oder 3D-Drucker und Laseranlagen zur Verfügung.
Infrastruktur und Geräte
Die Infrastruktur zur Herstellung verschiedener Mikrosystem-Technologien besteht aus drei strukturellen Einheiten:
- Reinraum 1 für fotolithografische, nasschemische sowie beschichtungstechnische Arbeiten
- Reinraum 2 für additive Drucktechniken
- Laseranlage (SLE)
Die Reinräume befinden sich im 4.OG im universitären Teil des BBZ am Deutschen Platz 5 in Leipzig (Raum 1.417.1 und 1.419.1). Beide Reinräume mit den darin befindlichen Geräten, wie zum Beispiel 3D-Printer, Sandstrahler, Lasercutter oder Bandsäge sind der Professur für Biochemische Zelltechnologie zugeordnet. Die Laseranlage zur Strukturierung von Gläsern ist im Institut für Analytische Chemie (Linnéstraße 3, Leipzig, 1.OG) lokalisiert und wird gemeinsam von den Professuren für Konzentrationsanalytik (Fakultät für Chemie) und Biochemische Zelltechnologie (BBZ) betrieben.
Die in der Technologieplattform integrierten Geräte und Anlagen besitzen eine sehr große Bandbreite an Spezifikationen, so dass sowohl die Möglichkeit der Prototypenfertigung als auch die Herstellung von Kleinserien besteht. Mögliche Leistungen und realisierbare Stückzahlen, die angeboten werden können, sind in der Leistungsübersicht zusammengefasst.
Umfassende Informationen zur Infrastruktur, zu Leistungen, Nutzungsmodellen und den Preisen der Core Facility Mikrosystem-Technologien sowie ein Onlineformular um Angebote anzufragen finden Sie auf der Website des Gerätezentrums:
Kontakt
Serviceleistungen
- Bestimmung des Molekulargewichts
- Probencharakterisierung mittels LC-MS
- Bestätigung von Strukturen und Strukturaufklärung
- Aminosäure-, Lipid-, Peptid- und Proteinanalytik
- Quantifizierung von Inhaltsstoffen mittels LC-MS/MS und LCxLC-IMS-MS/MS
- MALDI-Imaging Analysen
Diese Technologieplattform umfasst fünf Massenspektrometer mit unterschiedlichen Ionenquellen, die nahezu das gesamte Probenspektrum der organischen und biochemischen Analytik abdecken. Mit den schonenden Ionisierungsverfahren MALDI (Matrix-unterstützte Laser Desorption/Ionisierung) und ESI (Elektrospray-Ionisierung) können die Molekulargewichte kleiner organischer Moleküle bis hin zu hochmolekularen Biopolymeren (z.B. Proteine und Enzyme) mit hoher Auflösung (>100.000) und Massengenauigkeit (< 1 ppm) bestimmt werden. Ergänzend bieten die vorhandenen MALDI-IMS-QTOF- (TOF =Flugzeit), ESI-IMS-QTOF (Q = Quadrupol), ESI-Orbitrap- und ESI-Iontrap-Tandem-Massenspektrometer aber auch die Möglichkeit der gezielten Fragmentierung von Molekülen (kollisioninduziert (CID) oder Elektrontransfer (ETD)). Die resultierenden Massenspektren ermöglichen die Identifizierung „beliebiger“ Substanzen in Datenbanken und die Aufklärung neuer bzw. die Bestätigung bekannter Strukturen (z.B. für Aminosäuren, Lipide, Peptide und Proteine). Alle Massenspektrometer können zudem mit analytischer oder Nano-RP-HPLC (oder -UPLC) gekoppelt werden, was eine umfassende Analyse komplexer Proben gestattet. Auch können Gewebeschnitte mittels MALDI-IMS-QTOF analysiert werden (Probenvorbereitung nach Absprache möglich). Hochkomplexe Proben können zudem mehrdimensional getrennt werden, in dem zusätzlich eine orthogonale Flüssigchromatographie (LCxLC), ein Ionenmobilitätsspektrometer (LCxIMS) oder eine elektrophoretische Methode verwendet werden.
Weitere Informationen
Kontakt
Serviceleistungen
- Synthese beliebiger Peptide, bestehend aus den 20 proteinogenen Aminosäuren mit einer Kettenlänge von 6 bis 25 Resten (andere Peptide auf Anfrage; Peptidmengen von 5 bis 1000 mg sind routinemäßig möglich)
Folgende Modifikationen sind möglich:
- Phosphorylierungen an Serin, Threonin und Tyrosin
- Acetylierung oder Biotinylierung von Aminogruppen
- O- und N-glykosylierte Ser/Thr- und Asn-Reste
- Glykierung an Lysin (Amadori- und Heynes-Peptide)
- Fluoreszenzfarbstoffe an Amino- und Thiolgruppen
- weitere Modifikationen auf Anfrage möglich
Bei der von Bruce Merrifield eingeführten Synthese an fester Phase können grundsätzlich Peptide beliebiger Sequenz und Länge synthetisiert werden. Bis zu einer Kettenlänge von 25 Resten ist die Synthese meist unproblematisch, so dass die Peptide in der Regel in hoher Ausbeute und Reinheit erhalten werden. Trotz der heute verfügbaren Schutzgruppen und Aktivierungsmethoden stellt die Synthese jedes Peptids eine individuelle Herausforderung dar. Etwa 1 – 5% aller Sequenzen sind problematisch und erfordern spezielle Synthesestrategien mit optimierter Reinigung. Die Arbeitsgruppe verwendet die Fmoc/tBu-Strategie, bei der die basenlabile Fluorenylmethoxycarbonyl-(Fmoc-) Gruppe temporär zum Schutz der α-Aminofunktion und tert.-Butyl-Schutzgruppen zum permanenten Schutz der Seitenketten trifunktioneller Aminosäuren eingesetzt werden. Die permanenten Schutzgruppen werden am Ende der Synthese mit Trifluoressigsäure abgespalten, wobei zugleich das Peptid vom festen Träger abgespalten wird. Diese Rohpeptide können bei vielen Versuchen direkt eingesetzt werden. Sind höhere Reinheiten gewünscht, können die Peptide mittels Umkehrphasen-Chromatographie (RP-HPLC) gereinigt werden.
Kontakt
Serviceleistungen
- Kristallisationsscreens
- Kristallographische Datenaufnahme
- Röntgenstrukturanalyse
- Strukturinterpretation
- Lichtstreuung
- Isotherme Titrationskalorimetrie
- Mikrothermophorese
Ziel der Technologieplattform ist die Kristallisation von Proteinen zur Bestimmung der Raumstruktur mittels Röntgenkristallographie. Ausgehend von einigen Milligramm hoch aufgereinigtem Protein werden zunächst die Kristallisationsbedingungen durch ein Screeningverfahren mit ca. 1.000 unterschiedlichen Bedingungen bestimmt und optimiert. Die Kristallisierbarkeit einer Proteinprobe wird innerhalb von etwa 4 bis 8 Wochen festgestellt. Wenn geeignete Kristalle erhalten wurden, erfolgt die Datensammlung an zwei Messstationen mit Drehanodengeneratoren im Haus oder durch die Verwendung von Synchrotronstrahlung. Neben der Strukturbestimmung von Proteinen und Protein-Ligand-Komplexen können Molecular Modelling-Arbeiten zum rationalen Enzymdesign oder zur strukturbasierten Wirkstoffentwicklung durchgeführt werden. Typische Fragestellungen sind die Optimierung der Bindungsaffinität oder der pharmakologischen Eigenschaften eines bekannten Liganden.
Im Enzym-Design ist die geplante Veränderung der Substratbindetasche zur Erlangung neuer oder breiterer Substratspezifitäten das häufigste Ziel.

Kontakt
Serviceleistungen
- umfassende Proteomstudien (2D-Gele und LCxLC-MS)
- 2D-Gelelektrophorese und 2D-Blots (diverse Färbe- und Detektionstechniken)
- Quantifizierung von Western-Blot (verschiedene Methoden)
- enzymatische Spaltung im Gel bzw. in Lösung
- Sequenzanalyse von Peptiden mit MALDI-TOF/TOF-MS oder statischem nanoESI-QqTOF-MS (je nach Fragestellung)
- De-novo Sequenzierung unbekannter Proteine und Peptide
- Identifizierung posttranslationaler Modifikationen
- Saturation- und Minimal-Labeling
Pharmakokinetik-Studien
Die Arbeiten der Technologieplattform umfassen Gel- und HPLC (UPLC)-MS-basierte Proteomanalysen, einschließlich Probenvorbereitung,-aufarbeitung und der Auswertung mit unterschiedlichen Softwarepaketen und Datenbanken. Die Gelbasierte Proteomik nutzt in der Regel die 2D-Gelelektrophorese (IEF/SDS-PAGE; 7 cm x 10 cm bis zu 24 cm x 20 cm), eventuell in Kombination mit 2D-Blots, wobei je nach Fragestellung unterschiedlich sensitive Färbemethoden eingesetzt werden können. Proteinspots können automatisch ausgeschnitten, tryptisch im Gel verdaut (andere Proteasen auf Anfrage) und massenspektrometrisch identifiziert werden (MALDI-TOF/TOF- bzw. LC-ESI-MS/MS). Alternativ kann eine enzymatisch verdaute Probe (z.B. Plasma, Serum oder Zellaufschluss) nach ein- oder zweidimensionaler Chromatographie direkt massenspektrometrisch analysiert werden. Dabei können mehrere Tausend Proteine identifiziert und relativ quantifiziert werden. Eine exakte Quantifizierung kann über Isotopen-markierte Standards (Synthese im eigenen Labor) erreicht werden, beispielsweise für Pharmakokinetik-Studien.
Weitere Informationen
Kontakt
Serviceleistungen
- Zu den in der Plattform eingesetzten Techniken gehören verschiedene Strategien der Generierung von Überexpressionsvektoren mit gentechnischen Methoden, die Proteinexpression in E. coli, HEK293 sowie Insektenzellen, Proteinanalytik und schließlich die Isolierung von hochreinen Proteinproben.
In dieser Technologieplattform werden Proteine für strukturelle und funktionelle Untersuchungen zur Verfügung gestellt. Während die Proteinproduktion bis vor einigen Jahren ausschließlich durch bakterielle Expression in E. coli realisiert wurde, werden nun zunehmend höhere Expressionssysteme für die Präparation eukaryontischer Proteine eingesetzt. Die Präparation von Milligramm-Mengen an eukaryontischen Proteinen ist eine Schlüsseltechnologie für medizinische, strukturbiologische und pharmakologisch motivierte Projekte in Leipzig. Dazu wurden Systeme zur effizienten Überexpression in HEK293-Zellen etabliert. Diese Zelllinien werden insbesondere für die Präparation von eukaryontischen extrazellulären Proteinen genutzt. Weiterhin wird die Expression in Baculovirus-Insektenzellsystemen genutzt, insbesondere für cytosolische Proteine und Membranproteine. Für den Zellaufschluss und die Proteinpräparation stehen mit fünf Äkta-Chromatographieanlagen im Labor Kapazitäten für die nachfolgenden Schritte der Proteinreinigung zur Verfügung.
Kontakt
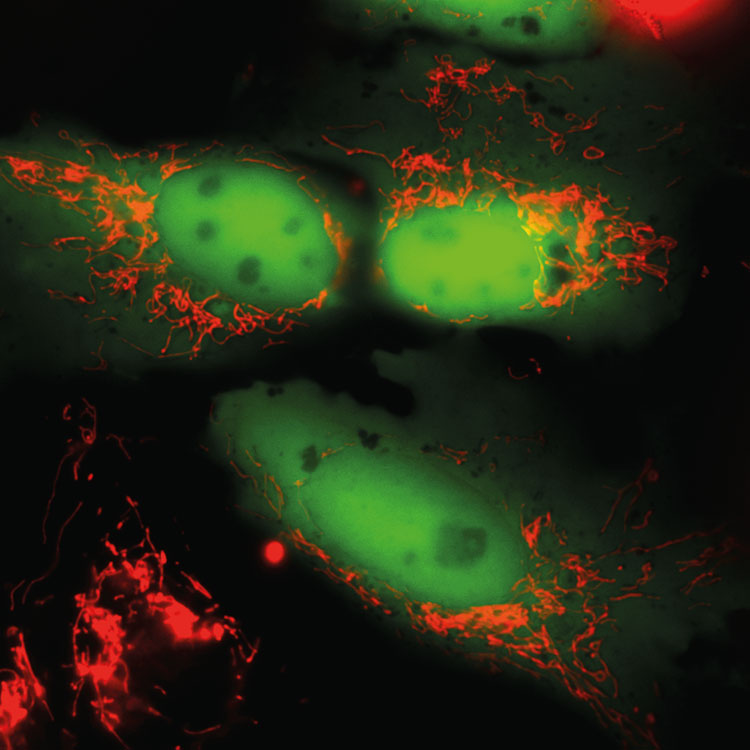
Die Technologieplattform Life Imaging stellt dem Interessenten ein konfokales Laserscanning Mikroskop des Typs Leica TCS SP5 zur Verfügung. Mit diesem Mikroskop ist es dem Anwender gegenüber herkömmlichen Lichtmikroskopen möglich, das Licht einzufangen, das aus einer einzelnen Ebene der Probe emittiert wird. Diese optischen Schnitte ermöglichen schärfere Bilder sowie eine deutliche Verbesserung der 3D-Aufnahmen dickerer Proben. Ein weiterer Vorteil liegt in der Möglichkeit der simultanen Aufnahme unterschiedlicher Farbstoffe auf mehreren Kanälen. Zudem hat das Mikroskop eine hohe Sensitivität, wodurch auch sehr geringe Signale noch detektier- und darstellbar sind.
Durch die Verwendung einer temperierten und mit CO2 begasbaren Inkubationskammer ist es zudem möglich, lebende Zellen über einen längeren Zeitraum zu beobachten. Die Arbeit an dem konfokalen Lasermikroskop Leica TCS SP5 erfordert gerätespezifische Kenntnisse für die Bedienung. In der Vorbereitung darauf bietet die Professur nach Absprache Kurse an, in denen Kenntnisse über die physikalischen Abläufe konfokaler Lasermikroskopie, die Probenpräparationen und die Bedienung des TCS SP5 vermittelt werden.
Serviceleistungen
- Konfokale Laserscanning Mikroskopie an lebenden und fixierten Proben (Life Imaging ist an lebenden Zellen über längere Zeiträume (1–24 Stunden) möglich)
- Mikroskopierkurse für konfokale Laserscanning Mikroskopie
Durchflusszytometrie Einführungstext
Serviceleistungen
- Durchflusszytometrische Analyse mit bis zu 20 Parametern gleichzeitig (extra- und intrazellulär)
- Durchflusszytometrische Sortierung von bis zu vier Zellpopulationen parallel mit bis zu 15 Parametern gleichzeitig
- Durchführung der Durchflusszytometrie als Multi-User-Einheit: Messungen werden nach gründlicher Einarbeitung durch Personal der Core Unit, vom Nutzer selber durchgeführt (alle Maßnahmen zum Geräteunterhalt, zur Vorbereitung der Geräte, speziell des Zellsortierers sowie zur Messung werden vom zuständigen Personal durchgeführt)
Die Core-Unit Durchflusszytometrie (CUDZ) stellt zwei Hochleistungsdurchflusszytometer für Analyse und Sortierung von Biostoffen (Zellen, Bakterien, einzellige Parasiten u.ä.) zur Verfügung. Mit Hilfe des Analysegeräts LSRFortessa ist es möglich, Zellcharakterisierungen auf sehr hohem Niveau durchzuführen. Aufgrund der großen Anzahl an Parametern, die man gleichzeitig analysieren kann, ist es möglich z.B. Zellaktivierungszustände zu untersuchen und parallel dazu Zytokinprofile zu messen. Hierzu bietet sich eine intrazelluläre Färbung an. Durch die Ausstattung mit einem UVLaser ist auch die Analyse mit DNAFarbstoffen zur Charakterisierung von Stammzellen (Side Population) und der Messung von Calciumströmen möglich. Durch Verwendung von speziellen Färbetechniken, wie z.B. Phospho-Flow, können intrazelluläre Signalwege untersucht werden. Hierfür werden weit weniger Zellen benötigt als für die herkömmliche Untersuchung mit Western Blots. Der Hochgeschwindigkeits-Zellsortierer FACSAria III dient zur schnellen und schonenden Sortierung von Biostoffen (Zellen, Bakterien, einzellige Parasiten u.ä.). Die Proben können steril sortiert werden, so dass die sortierten Zellen anschließend zu weiteren Kultivierungsexperimenten genutzt werden können. Auch Einzelzellsortierungen sind z.B. für RNASeq-Untersuchungen möglich. Maximal können vier verschiedene Fraktionen in einem Durchgang sortiert werden. Die Geräte stehen in einem S2-Bereich (nach Infektionsschutz- und Gentechnik-Gesetz). Daher ist es auch möglich, infektiöse Proben zu analysieren/sortieren, als auch gentechnisch veränderte Organismen zu untersuchen.

Kontakt
Weitere Technologieangebote
Über die Methoden- und Gerätepools in der BIO CITY hinaus bieten unsere Forschungsgruppen ihre Expertise auch anderen Forschungsinstituten und Unternehmen aus dem Life Science Sektor in Form von Technologieangeboten an. Diese Angebote werden von den Technologietransferbeauftragten des Dezernat für Forschung und Transfer betreut.
Gehe zu den Technologieangeboten im Bereich Transfer